Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра физики
РЕФЕРАТ
Тема реферата: «Эволюция представлений о строении ядра атома»
ВЫПОЛНИЛ: СТ. ГР. БТЭ 13-01 А.А.АБДРАХМАНОВ
ПРОВЕРИЛ: ПРЕПОДАВАТЕЛЬ А.А.Е.КУРАМШИНА
УФА 2014
Введение
Основная часть
Постулаты Бора
Строение атомного ядра
Опыты Резерфорда
Заключение
Введение
Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Атомы очень малы - их размеры порядка 10- 10 -10- 9 м, а размеры ядра еще примерно в 100 000 раз меньше (10- 15 -10- 14 м). Поэтому атомы можно «увидеть» только косвенным путем, на изображении с очень большим увеличением (например, с помощью автоэлектронного проектора). Но и в этом случае атомы не удается рассмотреть в деталях. Наши знания об их внутреннем устройстве основаны на огромном количестве экспериментальных данных, которые косвенно, но убедительно свидетельствуют в пользу сказанного выше.
Представления о строении атома радикально изменились в 20 в. под влиянием новых теоретических идей и экспериментальных данных. В описании внутреннего строения атомного ядра до сих пор остаются нерешенные вопросы, которые служат предметом интенсивных исследований. В следующих разделах излагается история развития представлений о строении атома как целого; строению ядра посвящена отдельная статья (АТОМНОГО ЯДРА СТРОЕНИЕ), поскольку эти представления развивались в значительной степени независимо. Энергия, необходимая для исследования внешних оболочек атома, относительно невелика, порядка тепловой или химической энергии. По этой причине электроны были экспериментально обнаружены задолго до открытия ядра.
Ядро же при его малых размерах очень сильно связано, так что разрушить и исследовать его можно только с помощью сил, в миллионы раз более интенсивных, нежели силы, действующие между атомами. Быстрый прогресс в понимании внутренней структуры ядра начался лишь с появлением ускорителей частиц. Именно это огромное различие размеров и энергии связи позволяет рассматривать структуру атома в целом отдельно от структуры ядра.
Чтобы составить представление о размерах атома и незаполненности занимаемого им пространства, рассмотрим атомы, составляющие каплю воды диаметром 1 мм. Если мысленно увеличить эту каплю до размеров Земли, то атомы водорода и кислорода, входящие в молекулу воды, будут иметь в поперечнике 1-2 м. Основная же часть массы каждого атома сосредоточена в его ядре, поперечник которого при этом составил всего 0,01 мм.
Основная часть
Эволюция представлений о строении атомов
Открытие сложного строения атома - важнейший этап становления современной физики. В процессе создания количественной теории строения атома, позволившей объяснить атомные системы, были сформированы новые представления о свойствах микрочастиц, которые описываются квантовой механикой.
Представление об атомах как неделимых мельчайших частицах веществ, как уже отмечалось выше, возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743-1794), великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона (1766-1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д.И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. было экспериментально доказано, что электрон является одной из основных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе Менделеева, наталкивает на мысль о том, что в основе строения всех атомов лежит общее свойство: все они находятся в близком родстве друг с другом.
Однако до конца XIX в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Различные предположения о строении атома долгое время не подтверждались какими-либо экспериментальными данными. Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при определенных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома.
Первые косвенные подтверждения о сложной структуре атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Изучение свойств этих лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, близкой к скорости света. Особыми приемами удалось определить массу катодных частиц и величину их заряда, выяснить, что они не зависят ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов и превращены в электронейтральные частицы: электрический заряд составляет сущность их природы. Эти частицы, получившие название электронов, были открыты в 1897 г. английским физиком Дж. Томсоном.
Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Томсон предложил первую модель атома, представив атом как сгусток материи, обладающий положительным электрическим зарядом, в который вкраплено столько электронов, что превращает его в электрически нейтральное образование. В этой модели предполагалось, что под влиянием внешних воздействий электроны могли совершать колебания, т. е. двигаться ускоренно. Казалось бы, это позволяло ответить на вопросы об излучении света атомами вещества и гамма-лучей атомами радиоактивных веществ.
Положительно заряженных частиц внутри атома модель атома Томсона не предполагала. Но как же тогда объяснить испускание положительно заряженных альфа-частиц радиоактивными веществами? Модель атома Томсона не давала ответа и на некоторые другие вопросы.
В 1911 г. английским физиком Э. Резерфордом при исследовании движения альфа-частиц в газах и других веществах была обнаружена положительно заряженная часть атома. Дальнейшие более тщательные исследования показали, что при прохождении пучка параллельных лучей сквозь слои газа или тонкую металлическую пластинку выходят уже не параллельные лучи, а несколько расходящиеся: происходит рассеяние альфа-частиц, т. е. отклонение их от первоначального пути. Углы отклонения невелики, но всегда имеется небольшое число частиц (примерно одна из нескольких тысяч), которые отклоняются очень сильно. Некоторые частицы отбрасываются назад, как если бы на пути встретилась непроницаемая преграда. Это не электроны - их масса гораздо меньше массы альфа-частиц. Отклонение может происходить при столкновении с положительными частицами, масса которых того же порядка, что и масса альфа-частиц. Исходя из этих соображений, Резерфорд предложил следующую схему строения атома.
В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарная модель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
Постулаты Бора
Планетарная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц вещества, однако возникли принципиальные трудности при обосновании устойчивости атомов.
Первая попытка построить качественно новую - квантовую - теорию атома была предпринята в 1913 г. Нильсом Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил ядерную модель Резерфорда. Он предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы - очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности. В основу своей теории атома Бор положил следующие постулаты.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
Этот постулат находится в противоречии с классической теорией. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантовые значения момента импульса.
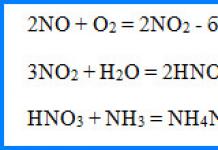
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
равной разности энергий соответствующих стационарных состояний (Еn и Еm - соответственно энергии стационарных состояний атома до и после излучения/поглощения).
Переходу электрона со стационарной орбиты под номером m на стационарную орбиту под номером n соответствует переход атома из состояния с энергией Еm в состояние с энергией Еn (рис.1).
Рис. 1 К пояснению постулатов Бора
ри Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn < Еm - его поглощение (переход атома в состояние с большей энергией, т. е, переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот
квантовых переходов и определяет линейчатый спектр атома.
Теория Бора блестяще объяснила экспериментально наблюдаемый линейчатый спектр водорода.
Успехи теории атома водорода были получены ценой отказа от фундаментальных положений классической механики, которая на протяжении более 200 лет остается безусловно справедливой. Поэтому большое значение имело прямое экспериментальное доказательство справедливости постулатов Бора, особенно первого - о существовании стационарных состояний. Второй постулат можно рассматривать как следствие закона сохранения энергии и гипотезы о существовании фотонов.
Немецкие физики Д. Франк и Г. Герц, изучая методом задерживающего потенциала столкновение электронов с атомами газов (1913г.), экспериментально подтвердили существование стационарных состояний и дискретность значений энергии атомов.
Несмотря на несомненный успех концепции Бора применительно к атому водорода, для которого оказалось возможным построить количественную теорию спектра, создать подобную теорию для следующего за водородом атома гелия на основе представлений Бора не удалось. Относительно атома гелия и более сложных атомов теория Бора позволила делать лишь качественные (хотя и очень важные) заключения. Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось весьма условным. На самом деле движение электронов в атоме имеет мало общего с движением планет по орбитам.
В настоящее время с помощью квантовой механики можно ответить на многие вопросы, касающиеся строения и свойств атомов любых элементов.
атом ядро бор менделеев
Строение атомного ядра
Нуклонный уровень
Примерно через 20 лет после того, как Резерфорд «разглядел» в недрах атома его ядро, был открыт нейтрон - частица по всем своим свойствам такая же, как ядро атома водорода - протон, но только без электрического заряда. Нейтрон оказался чрезвычайно удобен для зондирования внутренности ядер. Поскольку он электрически нейтрален, электрическое поле ядра не отталкивает его - соответственно, даже медленные нейтроны могут беспрепятственно приблизиться к ядру на расстояния, при которых начинают проявляться ядерные силы. После открытия нейтрона физика микромира двинулась вперед семимильными шагами.
Вскоре после обнаружения нейтрона два физика-теоретика - немецкий Вернер Гейзенберг и советский Дмитрий Иваненко - выдвинули гипотезу о том, что атомное ядро состоит из нейтронов и протонов. На ней базируется современное представление о строении ядра.
Протоны и нейтроны объединяются словом нуклон. Протоны - это элементарные частицы, которые являются ядрами атомов легчайшего химического элемента - водорода. Число протонов в ядре равно порядковому номеру элемента в таблице Менделеева и обозначается Z (число нейтронов - N). Протон имеет положительный электрический заряд, по абсолютному значению равный элементарному электрическому заряду. Он примерно в 1836 раз тяжелее электрона. Протон состоит из двух и-кварков с зарядом Q = + 2/3 и одного d-кварка с Q = - 1/3, связанных глюонным полем. Он имеет конечные размеры порядка 10-15 м, хотя его нельзя представить как твердый шарик, он скорее напоминает облако с размытой границей, состоящее из рождающихся и аннигилирующих виртуальных частиц.
Электрический заряд нейтрона равен 0, масса его - примерно 940 МэВ. Нейтрон состоит из одного u-кварка и двух d-кварков. Эта частица устойчива только в составе стабильных атомных ядер, свободный нейтрон распадается на электрон, протон и электронное антинейтрино. Период полураспада нейтрона (время, за которое распадается половина первоначального количества нейтронов) равен примерно 12 мин. В веществе в свободном виде нейтроны существуют еще меньше времени вследствие сильного поглощения их ядрами. Как и протон, нейтрон участвует во всех видах взаимодействий, в том числе в электромагнитном: при общей нейтральности вследствие сложного внутреннего строения в нем существуют электрические токи.
В ядре нуклоны связаны силами особого рода - ядерными. Одна из характерных их особенностей - короткодействие: на расстояниях порядка 10-15 м и меньше они превышают любые другие силы, вследствие чего нуклоны не разлетаются под действием электростатического отталкивания одноименно заряженных протонов. При больших расстояниях ядерные силы очень быстро уменьшаются до нуля.
Механизм действия ядерных сил основан на том же принципе, что и электромагнитных - на обмене взаимодействующих объектов виртуальными частицами.
Виртуальные частицы в квантовой теории - это частицы, которые имеют такие же квантовые числа (спин, электрический и барионный заряды и др.), как и соответствующие реальные частицы, но для которых не выполняется обычная связь между энергией, импульсом и массой.
Опыты Резерфорда
В магнитном поле поток радиоактивного излучения распадается на 3 составляющих:альфа- лучи, бета-лучи и гамма-лучи.
Явление радиоактивности свидетельствовало о сложном строении атома
Опыт Резерфорда по рассеянию альфа-частиц
1911г. - Э. Резерфорд ставит опыт по рассеянию альфа-частиц. Пучок aльфа-частиц пропускался через тонкую золотую фольгу.
Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой.
Некоторые альфа-частицы проходили сквозь фольгу, образуя на экране размытое пятно, а следы от других альфа-частиц были зафиксированы на боковых экранах.
Опыт показал, что положительный заряд атома сконцентрирован в очень малом объеме - ядре, а между ядрами атомов существуют большие промежутки.
Резерфорд показал, что модель Томсона находится в противоречии с его опытами.
Заключение
В заключении, приходим к выводу, что концепции Резерфорда -- Бора уже больше частичек абсолютной истины, хотя дальнейшее развитие физики обнаружило и в этой концепции немало погрешностей. Еще большая часть абсолютно верного знания содержится в квантово-механической теории атома.
Открытие сложной структуры атома стало крупнейшим событием в физике, поскольку оказались опровергнутыми представления классической физики об атомах как твердых и неделимых структурных единицах вещества
Список использованных источников
1. Физика для всех / Купер Л.- «Мир»1974 г.
2. Физики / Храмов Ю.А.- «Наука» 1983 г.
3. Физика -9,11 / Перышкин А.В.- «Дрофа» 2004 г.
4. П.С. Кудрявцев. «Курс истории физики» М.1982.
5. М.П. Бронштейн. «Атомы и электроны» М. 1980.
6. Интернет-ресурсы.
7. http://www.rcio.rsu.ru/.
Размещено на Allbest.ru
...Подобные документы
Анализ развития идей атомизма в истории науки. Роль элементарных частиц и физического вакуума в строении атома. Суть современной теории атомизма. Анализ квантовой модели атома. Введение понятия "молекула" Пьером Гассенди. Открытие эффекта Комптона.
контрольная работа , добавлен 15.01.2013
Исследование концепции динамической структуры атома в пространстве. Изучение структуры атома и атомного ядра. Описания динамики движения тел в реальном пространстве потенциальных сфер. Анализ спирального движения квантовых частиц в свободном пространстве.
реферат , добавлен 29.05.2013
Планетарная модель атома Резерфорда. Состав и характеристика атомного ядра. Масса и энергия связи ядра. Энергия связи нуклонов в ядре. Взаимодействие между заряженными частицами. Большой адронный коллайдер. Положения теории физики элементарных частиц.
курсовая работа , добавлен 25.04.2015
История открытий в области строения атомного ядра. Модели атома до Бора. Открытие атомного ядра. Атом Бора. Расщепление ядра. Протонно-нейтронная модель ядра. Искусственная радиоактивность. Строение и важнейшие свойства атомных ядер.
реферат , добавлен 08.05.2003
Модели строения атома. Формы атомных орбиталей. Энергетические уровни атома. Атомная орбиталь как область вокруг ядра атома, в которой наиболее вероятно нахождение электрона. Понятие протона, нейтрона и электрона. Суть планетарной модели строения атома.
презентация , добавлен 12.09.2013
Складові частини атома: ядро, протони, нейтрони та електрони. Планетарна модель атома або модель Резерфорда. Керована та некерована ланцюгова ядерна реакція. Поняття ядерного вибуху як процесу вивільнення великої кількості теплової і променевої енергії.
презентация , добавлен 21.05.2012
Открытие сложного строения атома - важнейший этап становления современной физики. В процессе создания количественной теории строения атома, объясняющей атомные системы, сформированы представления о свойствах микрочастиц, описанные квантовой механикой.
реферат , добавлен 05.01.2009
История зарождения и развития атомистической теории. Представления Платона и Аристотеля о непрерывности материи. Корпускулярно-кинетическая теория тепла, открытие радиоактивности. Ранняя планетарная модель атома Нагаоки. Определение заряда электрона.
презентация , добавлен 28.08.2013
Эволюция представлений о строении атомов на примере моделей Эрнеста Резерфорда и Нильса Бора. Стационарные орбиты и энергетические уровни. Объяснение происхождения линейчатых спектров излучения и поглощения. Достоинства и недостатки теории Н. Бора.
реферат , добавлен 19.11.2014
Этапы исследований строения атома учеными Томсоном, Резерфордом, Бором. Схемы их опытов и интерпретация результатов. Планетарная модель атома Резерфорда. Квантовые постулаты Бора. Схемы перехода из стационарного состояния в возбужденное и наоборот.
Как устроен окружающий мир?
Этот вопрос интересовал древних мудрецов, философов средневековья, учёных других эпох. Пытаясь дать объяснение наблюдаемым явлениям и фактам, они строили мысленные образы строения вещества. Однако, открытие новых явлений, нередко вызывало необходимость создания других, более совершенных, моделей.
Рассмотрим этот процесс на примере развития теории строения атома.
Эволюция представлений о строении атома
Понятие атома и основные принципы атомистической теории впервые были сформулированы в V-VIII до нашей эры выдающимися представителями Демокритом, Левкиппом, Эпикуром. Спустя несколько столетий они нашли поэтическое отражение в поэме римского философа и поэта Лукреция Кара «О природе вещей».
Открытие электрона
В средние века атомистические воззрения философов древности почти не имели сторонников. И лишь в XVII веке, когда химия выделилась в отдельную науку, многие учёные обратили свои взоры на атомизм.
Главными строительными деталями ядра являются положительные протоны и, не имеющие электрического заряда, нейтроны. Исключение составляет только водород. Его ядро состоит из одного единственного протона. Для обозначения атомных ядер используют запись вида:
- А - атомная масса — сумма протонов и нейтронов (нуклонов ядра);
- Z - номер элемента в таблице Менделеева, равный числу протонов в ядре.
Ядра атомов очень прочны, что объясняется действием особых внутриядерных сил. Именно эти силы удерживают вместе нуклоны ядра. Их главная особенность - короткодействующий характер. Т.е. они действуют лишь в пределах ядра.
Всего сейчас науке известны 118 видов атомов. Объединяясь в молекулы, они образуют всё многообразие веществ в природе.
Спустя столетие
Современная физика базируется на планетарной модели атома, дополненной впоследствии постулатами Бора и сведениями об атомном ядре. Атом невидим для невооруженного глаза, но «подсмотреть» за ним всё же можно в специальные виды микроскопов - электронный, атомный и др.
Далёкие спутники атомных ядер - электроны уже давно не считают просто отрицательно заряженными частицами. Всё гораздо мудрее и интереснее. Совокупность электронов в атоме называют «электронным облаком». Скорость его вращения и удаленность от ядра подчиняется определенным законам. Но особенно интересна особенность электронов - иметь массу и заряд как частица и в то же время проявлять волновые свойства. Эта двойственность носит название корпускулярно-волнового дуализма.
Чем совершеннее методы познания, тем глубже проникает человеческий разум в строение вещества. К настоящему времени установлено, что протоны и нейтроны имеют сложную структуру, состоящую из элементарных частиц - кварков.
Если это сообщение тебе пригодилось, буда рада видеть тебя
К началу XIX века окончательно утвердилось понятие, что атом представляет наименьшую частицу вещества, являющуюся носителем его свойств. Именно на анализе изменения свойств атомов был основан целый ряд таблиц элементов, а в 1869 г. Дмитрием Ивановичем Менделеевым сформулирован Периодический закон.
Начиная с середины XIX века, росло число экспериментальных фактов, свидетельствовавших прямо или косвенно о сложном характере строения атома.
Уильям Крукс (Crookes ) и позднее Джозеф Томсон (Thomson ) обнаружили катодные лучи – поток электронов, возникающий между двумя электродами в вакууме при приложении к ним разности потенциалов.
Анри Беккерель (Becquerel ) открыл явление естественной радиоактивности солей урана (a-, b- и g-излучение). Впоследствии было показано, что a-частицы это положительно заряженные ядра атомов гелия, b-частицы – поток электронов, аналогичный катодным лучам Крукса, g-излучение − поток квантов электромагнитного излучения, аналогичный X-лучам Рентгена.
Спектры излучения не взаимодействующих друг с другом свободных атомов представляют собой серии линий (узких полос) с определенными длинами волн (или соответственно частот), характерными для каждого атома. Для атомов водорода спектр излучения наиболее прост и состоит из ряда серий (исторически получивших имена Лаймана, Бальмера и др.) в видимой, УФ- и ИК-областях спектра. Была обнаружена эмпирическая формула зависимости, связывающей частоты излучения линий между собой:
где =1/l волновое число (характеристика, обычно используемая в спектроскопии); n i = 1,2,3 ,... (целые числа); R = 109677,58 см -1 – постоянная величина (постоянная Ридберга). Линейчатый характер спектров указывает на дискретный характер изменения энергии электронов в атоме.
Эрнест Резерфорд (Rutherford ) экспериментально установил, что атом состоит из малого по размеру положительно заряженного ядра, содержащего практически всю массу атома и расположенных вокруг него электронов, и предложил так называемую планетарную модель атома .
Работы Генри Мозли (Moseley ) по изучению характеристических рентгеновских спектров различных элементов позволили доказать, что порядковый номер элемента в Периодической системе совпадает с зарядом ядра атома.
Таким образом, атом представляет собой сложную систему, состоящую из полжительно заряженного ядра движущихся вокруг него электронов. Заряд ядра атома (выраженный в единицах элементарного электрического заряда) соответствует порядковому номеру элемента в Периодической таблице и равен числу электронов.
Теория строения атома Бора
Первой моделью атома, в которой были использованы идеи квантования энергии, стала теория Нильса Бора (Bohr ), разработанная на базе модели Резерфорда.
Основным недостатком планетарной модели строения атома Резерфорда было ее противоречие теории классической электродинамики, которая утверждает, что, двигаясь по круговой орбите, электрон как заряженная частица должен непрерывно излучать энергию и "достаточно быстро упасть на ядро". Нильс Бор пришел к выводу, что микрочастицы отличаются по свойствам от макрообъектов, поэтому классической электродинамики недостаточно для их описания. В своей теории Бор использовал представления классической механики о движении заряженной частицы в электрическом поле, дополнив их идеями квантования энергии. При этом он выдвинул три постулата (постулат – утверждение в теории, принимаемое за истинное, хотя и недоказуемое в рамках этой теории).
Первый постулат . Электроны в атоме могут двигаться только по некоторым определенным устойчивым стационарным круговым орбитам. При движении по этим орбитам электроны не излучают энергию, то есть существует ряд стационарных состояний атома, соответствующих определенным значениям его энергии.
Второй постулат. При переходе электрон с одной стационарной орбиты на другую атом испускает или поглощает квант электромагнитного излучения, энергия которого (h n) равна разности энергий стационарных состояний:
h n=E 1 –E 2 ,
где h – постоянна планка, n – частота излучения.
Третий постулат. В атоме существуют только такие электронные орбиты, находясь на которых электрон обладает моментом количества движения, кратным (часто вводят обозначение ):
M = m×v×r = ,
где M – момент количества движения электрона; m = 9,11×10 -31 кг – масса электрона; v – скорость электрона; r – радиус орбиты электрона; h = 6,63 ×10 -34 Дж×с – постоянная Планка; n = 1,2,3 ... – целое число, получившее название «квантовое число ».
Используя эти постулаты, Бор рассчитал размеры стационарных орбит электронов в атоме, энергию электронов на стационарных орбитах и выразил постоянную Ридберга через основные константы.
Так, в этой модели атом водорода представляет собой положительно заряженное ядро, вокруг которого по круговой орбите движется электрон. Используя представления классической механики о движении частицы по круговой орбите и постулаты Бора можно определить энергию электрона и радиус его орбиты.
Радиусы электронных орбит:
– сила кулоновского притяжения; k
= 1/4pe 0 , e 0 = 8.85×10 -12 Кл/Н×м 2 – электрическая постоянная; е
= 1.6×10 -19 Кл – единичный электрический заряд (заряд ядра и электрона)  – центробежная сила; ;
– центробежная сила; ;  – постулат Бора;
– постулат Бора;  – радиусы орбит электрона; n
= 1,2,3... – квантовое число.
– радиусы орбит электрона; n
= 1,2,3... – квантовое число.
Радиус первой (n =1) стационарной орбиты электрона для атома водорода составляет величину:
r 1 = h 2 /4p 2 e 2 mk = 5,29×10 -11 м ≈ 0,53 Å
и называется «радиус первой боровской орбиты» (1Å = 10 -10 м).
Энергия электрона
: ![]() – полная энергия электрона; – потенциальная энергия электрона; – кинетическая энергия электрона; – полная энергия электрона;
– полная энергия электрона; – потенциальная энергия электрона; – кинетическая энергия электрона; – полная энергия электрона; ![]() – радиус орбит электронов;
– радиус орбит электронов; ![]() .
.
Электрон, находящийся на первой стационарной орбите (n =1) атома водорода, будет обладать энергией
![]() = –2,17×10 -18 Дж = – 13,6 эВ; (1эВ=1,602×10 -19 Дж).
= –2,17×10 -18 Дж = – 13,6 эВ; (1эВ=1,602×10 -19 Дж).
Отрицательное значение энергии свидетельствует о том, что электрон связан с ядром. Для перевода электрона на бесконечное расстояние от ядра (удаление из атома) необходимо затратить энергию, называемую энергией ионизации (E и). Численное значение энергии электрона в основном состоянии атома водорода (E 1) совпадает с экспериментально определенной величиной E и.
 Набор стационарных орбит электрона может быть представлен в виде набора энергетических состояний (уровней) – рис. 2.1. При переходе электрона с более удаленной стационарной орбиты на менее удаленную энергия выделяется в виде квантов электромагнитного излучения. При поглощении энергии электрон переходит на более удаленные орбиты.
Набор стационарных орбит электрона может быть представлен в виде набора энергетических состояний (уровней) – рис. 2.1. При переходе электрона с более удаленной стационарной орбиты на менее удаленную энергия выделяется в виде квантов электромагнитного излучения. При поглощении энергии электрон переходит на более удаленные орбиты.
Рис. 2‑1 Диаграмма энергетических состояний электрона в атоме водорода: n – главное квантовое число; Е i – энергия электрона на i орбите; h n ij = E i - E j – квант электромагнитного излучения
Квантовое число n определяет энергию электрона и радиус орбит, по которым двигается электрон, обладающий соответствующей энергией.
Теория Бора сыграла положительную роль, открыв дорогу квантовой механике. Основное ее достоинство заключалось в количественном описании линейчатых спектров простейших атомов. С усовершенствованием приборов и техники спектроскопии обнаружили, что линии, принимавшиеся за единичные, в действительности состоят из нескольких близко расположенных друг к другу линий. Следовательно, для каждого квантового числа существует несколько близких друг к другу энергетических уровней. До некоторой степени это объяснил Арнольд Зоммерфельд (Sommerfeld ), который допустил существование в атоме эллиптических орбит. Было введено еще два дополнительных квантовых числа: побочное и магнитное, существование которых непосредственно не вытекало из теории Бора. Однако в целом необходимо констатировать, что в рамках классической физики не удалось создать "хорошую" модель описания поведения микрочастиц. Основным недостатком теории Бора для химии явилась невозможность дать даже качественное и тем более количественное описание химической связи.










Атомным ядром называется центральная часть атома, занимающая лишь триллионную до- лю его объема, но в которой сосредоточено более 99,9 его массы. Оно имеет форму, близкую к сферической или слабо вытянутой эллипсоидаль- ной. Объем его пропорционален массе, т.е. пло- тность почти постоянна и очень высока (около кг/м 3), а радиус возрастает от самых лег- ких ядер к самым тяжелым с до м. Атомное ядро несет положительный заряд, кратный абсолютной величине электронного заряда.





Простейшими ядерными превращениями яв- ляются - и -распад, когда в начальном состоянии существует одна частица – «материнское ядро», а в конечном - две, продукты распада. Существуют и ядерными более сложные процессы, называемые ядерными реакциями реакциями, когда сталкиваются два атомных ядра, а в результате образуются одно или более с перерас- пределением нуклонов между продуктами реакции. Между ядерными и химическими реакциями существует определенная аналогия, поэтому отрасль ядерной физики, занимающуюся изучением реакций, иногда называют ядерной химией.












Самый тяжелый элемент, встречающийся в 92-й природе в заметных количествах – 92-й элемент уран – уран, у которого известны три природных изо- 234 U 235 U 238 U топа – 234 U, 235 U, 238 U. Однако искусственно можно получить эле- Z менты с большими значениями Z, которые в таб- лице элементов должны располагаться за ураном. Они называются трансурановыми элементами трансурановыми элементами. Трансурановые элементы




98-гокалифорния Идя по этому пути дальше, можно получить еще более далекие трансурановые элементы. При длительном облучении в реакторе удается продвинуться вплоть до 98-го элемента - калифорния. Pu 238 U Однако с каждым новым этапом количество полу- чаемого вещества резко уменьшается. За год облучения в ядерном реакторе в Pu удается превратить около 1% 238 U. Примерно такой же выход даст и каждое следую- щее звено данного процесса. АZ Кроме того, с повышением А и Z начинает все сильнее сказываться конкурирующая роль -распадов и спонтанного (самопроизвольного) деления. Поэтому для получения очень далеких трансурановых элементов данный процесс оказывается непригодным.


Реакция с заряженными частицами Z В отличие от нейтрона тяжелая заряжен- ная частица, попадая в ядро, вносит в него свой электрический заряд и тем самым непосредственно изменяет значение Z. n 92 U 238 Pu Am 195 Pu 241 Так, например, в реакции (, n) на 92 U 238 сразу получается Pu 241, тут же распадаю- щийся в 24 Am 195, тогда как по первому способу для получения того же Pu 241 потре- бовалось три последовательных захвата нейтронов и два акта -распада.




Ядра с Z = были открыты до 1986 года. Z = 105 DubniumDb Учитывая заслуги исследователей из Дубны в от- крытии большого числа изотопов тяжелых элементов (), в 1997 году решением Генеральной Ассам- блеи чистой и прикладной химии элементу с Z = 105 было присвоено имя Dubnium (Db). Новый этап в исследовании сверхтяжелых ядер на- чался в 1994 году, когда была существенно повышена эффективность регистрации и усовершенствована ме- тодика наблюдения сверхтяжелых ядер – были обнару- жены изотопы 110, 111 и 112 элементов. В настоящее время существует информация о реги- страции ядер 114, 116 и даже 118 элементов.

Свойства трансурановых элементов ториялоуренсиемZ=103 актиноидами В химическом отношении все элементы, начиная с тория и кончая лоуренсием (Z=103), образуют группу очень сходных по своим свойствам элементов. По аналогии с группой лантаноидов эта группа называется актиноидами, поскольку они размещаются в одной клетке периодической системы вслед за элементом актинием. Все актиноиды - типичные металлы. Не смотря на значительное сходство, химические свойства актиноидов имеют и некоторые различия, что позволяет чисто химическими методами отделять их друг от друга. 104-йкурчатовий 104-й элемент - курчатовий стоит уже в следующей клеточке таблицы элементов и по своим свойствам аналогичен таким элементам, как Ti, Zr, Hf.





Человечество научилось использовать цепную реакцию деления тяжелых ядер двумя путями: в виде управляемой цепной реакции, реализованной в атомном реакторе для полу- чения энергии; в виде неуправляемой цепной реакции, реализованной в ядерной бомбе для военного применения.

Раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Атомы очень малы – их размеры порядка 10 –10 –10 –9 м, а размеры ядра еще примерно в 100 000 раз меньше (10 –15 –10 –14 м). Поэтому атомы можно «увидеть» только косвенным путем, на изображении с очень большим увеличением (например, с помощью автоэлектронного проектора). Но и в этом случае атомы не удается рассмотреть в деталях. Наши знания об их внутреннем устройстве основаны на огромном количестве экспериментальных данных, которые косвенно, но убедительно свидетельствуют в пользу сказанного выше.
Представления о строении атома радикально изменились в 20 в. под влиянием новых теоретических идей и экспериментальных данных. В описании внутреннего строения атомного ядра до сих пор остаются нерешенные вопросы, которые служат предметом интенсивных исследований. В следующих разделах излагается история развития представлений о строении атома как целого; строению ядра посвящена отдельная статья (АТОМНОГО ЯДРА СТРОЕНИЕ ), поскольку эти представления развивались в значительной степени независимо. Энергия, необходимая для исследования внешних оболочек атома, относительно невелика, порядка тепловой или химической энергии. По этой причине электроны были экспериментально обнаружены задолго до открытия ядра.
Ядро же при его малых размерах очень сильно связано, так что разрушить и исследовать его можно только с помощью сил, в миллионы раз более интенсивных, нежели силы, действующие между атомами. Быстрый прогресс в понимании внутренней структуры ядра начался лишь с появлением ускорителей частиц. Именно это огромное различие размеров и энергии связи позволяет рассматривать структуру атома в целом отдельно от структуры ядра.
Чтобы составить представление о размерах атома и незаполненности занимаемого им пространства, рассмотрим атомы, составляющие каплю воды диаметром 1 мм. Если мысленно увеличить эту каплю до размеров Земли, то атомы водорода и кислорода, входящие в молекулу воды, будут иметь в поперечнике 1–2 м. Основная же часть массы каждого атома сосредоточена в его ядре, поперечник которого при этом составил всего 0,01 мм.
Историю возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита (ок. 460 – ок. 370 до н. э.), много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур (ок. 342–270 до н.э.) принял атомную теорию, и в первом веке до н.э. один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме «О природе вещей», благодаря которой оно и сохранилось для следующих поколений. Аристотель (384–322 до н.э.), один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент.
В эпоху Возрождения начались систематические исследования в областях, именуемых ныне химией и физикой, принесшие с собой новые догадки о природе «неделимых частиц». Р.Бойль (1627–1691) и И.Ньютон (1643–1727) исходили в своих рассуждениях из представления о существовании неделимых частиц вещества. Однако ни Бойлю, ни Ньютону не потребовалось детальной атомистической теории для объяснения интересовавших их явлений, и результаты проведенных ими экспериментов не сказали ничего нового о свойствах «атомов».
СТРУКТУРА АТОМАЗаконы Дальтона. Первым действительно научным обоснованием атомистической теории, убедительно продемонстрировавшим рациональность и простоту гипотезы о том, что всякий химический элемент состоит из мельчайших частиц, явилась работа английского школьного учителя математики Дж.Дальтона (1766–1844), статья которого, посвященная этой проблеме, появилась в 1803.
Дальтон изучал свойства газов, в частности отношения объемов газов, вступавших в реакцию образования химического соединения, например, при образовании воды из водорода и кислорода. Он установил, что отношения прореагировавших количеств водорода и кислорода всегда представляют собой отношения небольших целых чисел. Так, при образовании воды (H 2 O) в реакцию с 16 г кислорода вступают 2,016 г газообразного водорода, а при образовании пероксида водорода (H 2 O 2) с 2,016 г водорода соединяются 32 г газообразного кислорода. Массы кислорода, реагирующие с одной и той же массой водорода при образовании этих двух соединений, соотносятся между собой как небольшие числа:
На основе подобных результатов Дальтон сформулировал свой «закон кратных отношений». Согласно этому закону, если два элемента соединяются в разных пропорциях, образуя разные соединения, то массы одного из элементов, соединяющиеся с одним и тем же количеством второго элемента, соотносятся как небольшие целые числа. По второму закону Дальтона, «закону постоянных отношений», в любом химическом соединении соотношение масс входящих в него элементов всегда одно и то же. Большое количество экспериментальных данных, относящихся не только к газам, но также и к жидкостям и твердым соединениям, собрал Й.Берцелиус (1779–1848), который провел точные измерения реагирующих масс элементов для многих соединений. Его данные подтвердили сформулированные Дальтоном законы и убедительно продемонстрировали наличие у каждого элемента наименьшей единицы массы.
Атомные постулаты Дальтона имели то преимущество перед абстрактными рассуждениями древнегреческих атомистов, что его законы позволяли объяснить и увязать между собой результаты реальных опытов, а также предсказать результаты новых экспериментов. Он постулировал, что 1) все атомы одного и того же элемента тождественны во всех отношениях, в частности, одинаковы их массы; 2) атомы разных элементов имеют неодинаковые свойства, в частности, неодинаковы их массы; 3) в соединение, в отличие от элемента, входит определенное целое число атомов каждого из составляющих его элементов; 4) в химических реакциях может происходить перераспределение атомов, но, ни один атом не разрушается и не создается вновь. (В действительности, как выяснилось в начале 20 в., эти постулаты не вполне строго выполняются, т.к. атомы одного и того же элемента могут иметь разные массы, например водород имеет три такие разновидности, называемые изотопами; кроме того, атомы могут претерпевать радиоактивные превращения и даже полностью разрушиться, но не в химических реакциях, рассматривавшихся Дальтоном.) Основанная на этих четырех постулатах атомная теория Дальтона давала самое простое объяснение законов постоянных и кратных отношений.
Хотя законы Дальтона лежат в основе всей химии, ими не определяются фактические размеры и массы атомов. Они ничего не говорят о числе атомов, содержащихся в определенной массе элемента или соединения. Молекулы простых веществ слишком малы, чтобы их можно было взвесить по отдельности, поэтому для определения масс атомов и молекул приходится прибегать к косвенным методам.
Число Авогадро. В 1811 А.Авогадро (1776–1856) выдвинул гипотезу, которая значительно упрощала анализ того, как из элементов образуются соединения, и устанавливала различие между атомами и молекулами. Его мысль состояла в том, что равные объемы газов, находящиеся при одинаковых температуре и давлении, содержат одно и то же число молекул. В принципе намек на это можно найти в более ранней работе Ж.Гей-Люссака (1778–1850), который установил, что отношение объемов газообразных элементов, вступающих в химическую реакцию, выражается целыми числами, хотя и отличными от отношений масс, полученных Дальтоном. Например, 2 л газообразного водорода (молекулы H 2), соединяясь с 1 л газообразного кислорода (молекулы O 2), образуют 1 л паров воды (молекулы H 2 O).
Истинное число молекул в данном объеме газа чрезвычайно велико, и до 1865 его не удавалось определить с приемлемой точностью. Однако уже во времена Авогадро проводились грубые оценки на основе кинетической теории газов. Очень удобной единицей измерения количества вещества является моль, т.е. количество вещества, в котором столько же молекул, сколько атомов в 0,012 кг самого распространенного изотопа углерода 12 С. Один моль идеального газа при нормальных условиях (н.у.), т.е. стандартных температуре и давлении, занимает объем 22,4 л. Число Авогадро – это полное число молекул в одном моле вещества или в 22,4 л газа при н.у. Другие методы, такие, как рентгенография, дают для числа Авогадро N 0 более точные значения, нежели полученные на основе кинетической теории. Значение, принятое в настоящее время, таково: 6,0221367Ч10 23 атомов (молекул) в одном моле. Следовательно, в 1 л воздуха содержится примерно 3Ч10 22 молекул кислорода, азота и других газов.
Важная роль числа Авогадро для физики атома связана с тем, что оно позволяет определить массу и приблизительные размеры атома или молекулы. Поскольку масса 22,4 л газообразного H 2 составляет 2,016Ч10 –3 кг, масса одного атома водорода равна 1,67Ч10 –27 кг. Если считать, что в твердом теле атомы расположены вплотную друг к другу, то число Авогадро позволит приближенно оценить радиус r , скажем, атомов алюминия. Для алюминия 1 моль равен 0,027 кг, а плотность – 2,7Ч10 3 кг/м 3 . При этом имеем