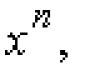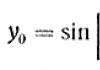В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, - несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе - за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, - нужно замедлить.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) - сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt . Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени :
n 2 − n 1 Δn
υ = –––––––––– = –––––––– = Δс/Δt (1)
(t 2 − t 1) v Δt v
где c = n / v - концентрация вещества,
Δ (читается «дельта») - общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO 2 + O 2 = 2SO 3
Скорость по кислороду будет: υ = 1: (10 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2: (10 1) = 0,2 моль/л·с - это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ . Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры . Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ . Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1) ! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Катализаторы - вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример - бурное разложение перекиси водорода при добавлении катализатора - оксида марганца (IV):
2H 2 O 2 = 2H 2 O + O 2
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы - вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров.
Скорость химической реакции зависит от следующих факторов:
1) Природа реагирующих веществ.
2) Поверхность соприкосновения реагентов.
3) Концентрация реагирующих веществ.
4) Температура.
5) Присутствие катализаторов.
Скорость гетерогенных реакций зависит также от:
а) величины поверхности раздела фаз (с увеличением поверхности раздела фаз скорость гетерогенных реакций увеличивается);
б) скорости подвода реагирующих веществ к поверхности раздела фаз и скорости отвода от нее продуктов реакции.
Факторы, влияющие на скорость химической реакции:
1. Природа реагентов. Большую роль играет характер химических связей в соединениях, строение их молекул. Например, выделение водорода цинком из раствора хлороводородной кислоты происходит значительно быстрее, чем из раствора уксусной кислоты, так как полярность связи Н-С1 больше, чем связи О-Н в молекуле СН 3 СООН, иначе говоря, из-за того, что НСl - сильный электролит, а СН 3 СООН - слабый электролит в водном растворе.
2. Поверхность соприкосновения реагентов. Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения. Реакции в растворах протекают практически мгновенно.
3. Концентрация реагентов. Чтобы произошло взаимодействие, частицы реагирующих веществ в гомогенной системе должны столкнуться. При увеличении концентрации реагирующих веществ скорость реакций увеличивается. Это объясняется тем, что при увеличении количества вещества в единице объема увеличивается число столкновений между частицами реагирующих веществ. Число столкновений пропорционально числу частиц реагирующих веществ в объеме реактора, т. е. их молярным концентрациям.
Количественно зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс (Гульдберг и Вааге, Норвегия, 1867 г.): скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции:
aA + bB ↔ cC + dD
скорость реакции в соответствии с законом действующих масс равна:
υ = k· [A ] υ a · [B ] υ b , (9)
где [А] и [В] - концентрации исходных веществ;
k - константа скорости реакции , которая равна скорости реакции при концентрациях реагирующих веществ [А] = [В] = 1 моль/л.
Константа скорости реакции зависит от природы реагирующих веществ, температуры, но не зависит от концентрации веществ.
Выражение (9) называется кинетическим уравнением реакции. В кинетические уравнения входят концентрации газообразных и растворенных веществ, но не входят концентрации твердых веществ:
2SO 2(г) + O 2(г) = 2SO 3(г) ; υ = k· 2 · [О 2 ];
СuО (тв.) + Н 2(г) = Сu (тв) + Н 2 О (г) ; υ = k· .
По кинетическим уравнениям можно рассчитывать, как изменяется скорость реакции при изменении концентрации реагирующих веществ.
Влияние катализатора.
5. Температура реакции. Теория активных соударений
Для того чтобы совершился элементарный акт химического взаимодействия, реагирующие частицы должны столкнуться друг с другом. Однако не каждое столкновение приводит к химическому взаимодействию. Химическое взаимодействие происходит в том случае, когда частицы приближаются на расстояния, при которых возможно перераспределение электронной плотности и возникновение новых химических связей. Взаимодействующие частицы должны обладать энергией, достаточной для преодоления сил отталкивания, возникающих между их электронными оболочками.
Переходное состояние - состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система находится в течение небольшого (10 -15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии. Существуют вещества, способные уменьшить энергию активации для данной реакции.
Активные молекулы А 2 и В 2 при столкновении объединяются в промежуточный активный комплекс А 2 ...В 2 с ослаблением, а затем и разрывом связей А-А и В-В и упрочнением связей А-В.
«Энергия активации» реакции образования НI (168 кДж/моль) значительно меньше, чем энергия, необходимая для полного разрыва связи в исходных молекулах Н 2 и I 2 (571 кДж/моль). Поэтому путь реакции через образование активного (активированного} комплекса энергетически более выгоден, чем путь через полный разрыв связей в исходных молекулах. Через образование промежуточных активных комплексов происходит подавляющее большинство реакций. Положения теории активного комплекса разработаны Г. Эйрингом и М. Поляни в 30 годах XX в.
Энергия активации представляет собой избыток кинетической энергии частиц относительно средней энергии, необходимой для химического превращения сталкивающихся частиц. Реакции характеризуются различными величинами энергии активации (Е а). В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Для биохимических процессов значения Е а зачастую ниже - до 20 кДж/моль. Это объясняйся тем, что абсолютное большинство биохимических процессов протекает через стадию фермент-субстратных комплексов. Энергетические барьеры ограничивают протекание реакции. Благодаря этому в принципе возможные реакции (при Q < 0) практически всегда не протекают или замедляются. Реакции с энергией активации выше 120 кДж/моль настолько медленны, что их протекание трудно заметить.
Для осуществления реакции молекулы при столкновении должны быть определенным образом ориентированы и обладать достаточной энергией. Вероятность надлежащей ориентации при столкновении характеризуют с помощью энтропии активации ∆S a . Перераспределению электронной плотности в активном комплексе благоприятствует условие, когда при столкновении молекулы А 2 и В 2 ориентированы, как это показано на рис. 3а, тогда как при ориентации, показанной на рис. 3б, вероятность реакции еще гораздо меньше - на рис. 3в.

Рис. 3. Благоприятная (а) и неблагоприятные (б, в) ориентации молекул А 2 и В 2 при столкновении
Уравнение, характеризующее зависимость скорости и реакции от температуры, энергии активации и энтропии активации, имеет вид:
![]() (10)
(10)
где k - константа скорости реакции;
А - в первом приближении общее число столкновений между молекулами за единицу времени (секунду) в единице объема;
е - основание натуральных логарифмов;
R - универсальная газовая постоянная;
Т - абсолютная температура;
Е а - энергия активации;
∆S a - изменение энтропии активации.
Уравнение (11) выведено Аррениусом в 1889 году. Предэкспоненциальный множитель А пропорционален общему числу соударений между молекулами в единицу времени. Его размерность совпадает с размерностью константы скорости и зависит от суммарного порядка реакции.
Экспонента равна доле активных соударений от их общего числа, т.е. столкнувшиеся молекулы должны иметь достаточную энергию взаимодействия. Вероятность же их нужной ориентации в момент соударения пропорциональна .
При обсуждении закона действующих масс для скорости (9) специально было оговорено, что константа скорости есть постоянная величина, не зависящая от концентраций реагентов. При этом предполагалось, что все химические превращения протекают при постоянной температуре. Вместе с тем, быстрота химического превращения может существенно изменяться при понижении или повышении температуры. С точки зрения закона действующих масс это изменение скорости обусловлено температурной зависимостью константы скорости, так как концентрации реагирующих веществ лишь незначительно меняются вследствие теплового расширения или сжатия жидкости.
Наиболее хорошо известным фактом является возрастание скорости реакций с увеличением температуры. Такой тип температурной зависимости скорости называется нормальным (рис. 3 а). Этот тип зависимости характерен для всех простых реакций.

Рис. 3. Типы температурной зависимости скорости химических реакций: а - нормальная;
б - аномальная; в - ферментативная
Однако в настоящее время хорошо известны химические превращения, скорость которых падает с увеличением температуры, такой тип температурной зависимости скорости называется аномальным . В качестве примера можно привести газофазную реакцию азота (II) оксида с бромом (рис. 3 б).
Особый интерес для медиков представляет зависимость от температуры скорости ферментативных реакций, т.е. реакций с участием ферментов. Практически все реакции, протекающие в организме, относятся к этому классу. Например, при разложении пероксида водорода в присутствии фермента каталазы скорость разложения зависит от температуры. В интервале 273-320 К температурная зависимость имеет нормальный характер. С увеличением температуры скорость возрастает, с уменьшением - падает. При подъеме температуры выше 320 К наблюдается резкое аномальное падение скорости разложения пероксида. Сходная картина имеет место и для других ферментативных реакций (рис. 3 в).
Из уравнения Аррениуса для k видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Зависимость скорости гомогенной реакции от температуры может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10° скорость реакции возрастает в 2-4 раза; число, показывающее во сколько раз возрастает скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции - γ.
Это правило математически выражается следующей формулой:
![]() (12)
(12)
где γ - температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 0 ; υ 1 – t 1 ; υ 2 – скорость реакции при температуре t 2 .
При повышении температуры в арифметической прогрессии скорость возрастает в геометрической.
Например, если γ = 2,9, то при возрастании температуры на 100° скорость реакции увеличивается в 2,9 10 раз, т.е. в 40 тыс. раз. Отклонения от этого правила составляют биохимические реакции, скорость которых увеличивается в десятки раз при незначительном повышении температуры. Это правило справедливо лишь в грубом приближении. Реакции, в которых участвуют крупные молекулы (белка), характеризуются большим температурным коэффициентом. Скорость денатурации белка (яичного альбумина) возрастает в 50 раз при повышении температуры на 10 °С. После достижения некоторого максимума (50-60 °С) скорость реакции резко понижается в результате термоденатурации белка.
Для многих химических реакций закон действующих масс для скорости неизвестен. В таких случаях для описания температурной зависимости скорости превращения может применяться выражение:
Предэкспонента А с не зависит от температуры, однако зависит от концентрации. Единицей измерения является моль/л∙с.
Теоретическая зависимость позволяет заранее рассчитывать скорость при любой температуре, если известны энергия активации и предэкспонента. Таким образом, прогнозируется влияние температуры на быстроту протекания химического превращения.
Сложные реакции
Принцип независимости. Все рассмотренное выше относилось к сравнительно простым реакциям, но в химии часто встречаются так называемые сложные реакции. К таким реакциям относятся рассматриваемые ниже. При выводе кинетических уравнений для этих реакций используют принцип независимости: если в системе протекает несколько реакций, то каждая из них независима от других и ее скорость пропорциональна произведению концентраций ее реагентов.
Параллельные реакции - это реакции, идущие одновременно в нескольких направлениях.
Термический распад хлората калия протекает одновременно по двум реакциям: ![]()
Последовательные реакции - это реакции, которые протекают в несколько стадий. Таких реакций в химии большинство.
![]() .
.
Сопряженные реакции. Если в системе протекают несколько реакций и протекание одной из них невозможно без другой, то эти реакции называются сопряженными , а само явление - индукцией .
2HI + Н 2 СrО 4 → I 2 + Сr 2 О 3 + Н 2 О.
Эта реакция в обычных условиях практически не наблюдается, но если в систему добавить FеО, то происходит реакция:
FеО + Н 2 СrО 4 → Fе 2 О 3 + Сr 2 O 3 + Н 2 О
и одновременно с ней идет первая реакция. Причиной этого является образование во второй реакции промежуточных продуктов, участвующих в первой реакции:
FеО 2 + Н 2 СrО 4 → Сr 2 О 3 + Fе 5+ ;
HI + Fе 5+ → Fе 2 О 3 + I 2 + Н 2 О.
Химическая индукция - явление, при котором одна химическая реакция (вторичная) зависит от другой (первичной).
А + В - первичная реакция,
А + С - вторичная реакция,
то А - активатор, В - индуктор, С - акцептор.
При химической индукции, в отличие от катализa, концентрации всех участников реакции уменьшаются.
Фактор индукции определяется из следующего уравнения:
![]() .
.
В зависимости от величины фактора индукции возможны следующие случаи.
I > 0 - затухающий процесс. Скорость реакции снижается со временем.
I < 0 - ускоряющийся процесс. Скорость реакции увеличивается со временем.
Явление индукции важно тем, что в ряде случаев энергия первичной реакции может скомпенсировать затраты энергии во вторичной реакции. По этой причине, например, оказывается термодинамически возможным синтез белков путем поликонденсации аминокислот.
Цепные реакции. Если химическая реакция протекает с образованием активных частиц (ионов, радикалов), которые, вступая в последующие реакции, вызывают появление новых активных частиц, то такая последовательность реакций называется цепной реакцией .
Образование свободных радикалов связано с затратой энергии на разрыв связей в молекуле. Эта энергия может быть сообщена молекулам путем освещения, электрического разряда, нагревания, облучения нейтронами, α- и β-частицами. Для проведения цепных реакций при невысоких температурах в реагирующую смесь вводят инициаторы - вещества, легко образующие радикалы: пары натрия, органические пероксиды, иод и т. д.
Реакция образования хлороводорода из простых соединений, активируемая светом.
Суммарная реакция:
Н 2 + С1 2 2НС1.
Отдельные стадии:
Сl 2 2Сl∙ фотоактивация хлора (инициирование)
Сl∙ + Н 2 = НСl + Н∙ развитие цепи
Н∙ + Сl 2 = НСl + Сl∙ и т. д.
Н∙ + Сl∙ = НСl обрыв цепи
Здесь Н∙ и Сl∙ - активные частицы (радикалы).
В этом механизме реакции можно выделить три группы элементарных стадий. Первая представляет собой фотохимическую реакцию зарождения цепи . Молекулы хлора, поглотив квант света, диссоциируют на свободные атомы, обладающие высокой реакционной способностью. Таким образом, при зарождении цепи происходит образование свободных атомов или радикалов из валентно-насыщенных молекул. Процесс зарождения цепи называют также инициированием . Атомы хлора, обладая непарными электронами, способны реагировать с молекулярным водородом, образуя молекулы хлороводорода и атомарного водорода. Атомарный водород, в свою очередь, вступает во взаимодействие с молекулой хлора, в результате чего снова образуется молекула хлороводорода и атомарный хлор и т. д.
Эти процессы, характеризующиеся повторением одних и тех же элементарных стадий (звеньев) и идущие с сохранением свободных радикалов, приводят к расходованию исходных веществ и образованию продуктов реакции. Такие группы реакций называют реакциями развития (или продолжения) цепи.
Стадия цепной реакции, при которой происходит гибель свободных радикалов, называется обрывом цепи . Обрыв цепи может наступить в результате рекомбинации свободных радикалов, если выделяющаяся при этом энергия может быть отдана какому-либо третьему телу: стенке сосуда или молекулам инертных примесей (стадии 4, 5). Вот почему скорость цепных реакций очень чувствительна к наличию примесей, к форме и размерам сосуда, особенно при малых давлениях.
Число элементарных звеньев от момента зарождения цепи до ее обрыва называют длиной цепи. В рассматриваемом примере на каждый квант света образуется до 10 5 молекул НСl.
Цепные реакции, в ходе которых не происходит «умножения» числа свободных радикалов, называются неразветвленными или простыми цепными реакциями . В каждой элементарной стадии неразветвленного цепного процесса один радикал «рождает» одну молекулу продукта реакции и только один новый радикал (рис. 41).
| |
Другие примеры простых цепных реакций: а) хлорирование парафиновых углеводородов Сl∙ + СН 4 → СН 3 ∙ + НС1; СН 3 ∙ + Сl - → СН 3 Сl + Сl∙ и т. д.; б) реакции радикальной полимеризации, например, полимеризация винилацетата в присутствии перекиси бензоила, легко распадающегося на радикалы; в) взаимодействие водорода с бромом, протекающее по механизму, аналогичному при реакции хлора с водородом, только с меньшей длиной цепи вследствие ее эндотермичности.
Если в результате акта роста появляются две или более активных частиц, то эта цепная реакция является разветвленной.
В 1925 г. Н. Н. Семенов и его сотрудники открыли реакции, содержащие элементарные стадии, в результате которых возникают не одна, а несколько химически активных частиц - атомов, или радикалов. Появление нескольких новых свободных радикалов приводит к появлению нескольких новых цепей, т.е. одна цепь разветвляется. Такие процессы называют разветвленными цепными реакциями (рис. 42).
Примером сильно разветвленного цепного процесса является реакция окисления водорода при низких давлениях и температуре около 900°С. Механизм реакции можно записать так.
1. H 2 + O 2 OH∙ + OH∙ зарождение цепи
2. ОН∙ + Н 2 → Н 2 О + Н∙ развитие цепи
3. Н∙ + О 2 → ОН∙ + О: разветвление цепи
4. О: + Н 2 → ОН∙ +Н∙
5. ОН∙ +Н 2 → Н 2 О + Н∙ продолжение цепи
6. Н∙ + Н∙ + стенка → Н 2 обрыв цепи на стенке сосуда
7. Н∙ + О 2 + М → НО 2 ∙ + М обрыв цепи в объеме.
М - инертная молекула. Радикал НО 2 ∙, образующийся при тройном соударении, малоактивен и не может продолжать цепь.
На первой стадии процесса образуются радикалы гидроксила, которые обеспечивают развитие простой цепи. В третьей же стадии в результате взаимодействия с исходной молекулой одного радикала образуются два радикала, причем атом кислорода обладает двумя свободными валентностями. Это и обеспечивает разветвление цепи.
В результате разветвления цепи скорость реакции в начальный период времени стремительно нарастает, и процесс заканчивается цепным воспламенением-взрывом. Однако разветвленные цепные реакции заканчиваются взрывом только в том случае, когда скорость разветвления больше скорости обрыва цепей. В противном случае наблюдается медленное течение процесса.
При изменении условий протекания реакции (изменение давления, температуры, состава смеси, размера и состояния стенок реакционного сосуда и т. д.) может произойти переход от медленного течения реакции к взрыву и наоборот. Таким образом, з цепных реакциях существуют предельные (критические) состояния, при которых происходит цепное воспламенение, от которого следует отличать тепловое воспламенение, возникающее в экзотермических реакциях в результате все увеличивающегося разогревания реагируемой смеси при слабом теплоотводе.
По разветвленному цепному механизму происходит окисле-кие паров серы, фосфора, оксида углерода (II), сероуглерода и т. д.
Современная теория цепных процессов разработана лауреатами Нобелевской премии (1956) советским академиком Н. Н. Семеновым и английским ученым Хиншельвудом.
Цепные реакции следует отличать от реакций каталитических, хотя последние носят и циклический характер. Самое существенное отличие цепных реакций от каталитических заключается в том, что при цепном механизме возможно течение реакции в направлении повышения энергии системы за счет самопроизвольно протекающих. Катализатор же термодинамически невозможную реакцию не вызывает. Кроме того, в каталитических реакциях отсутствуют такие стадии процесса, как зарождение и обрыв цепи.
Реакции полимеризации. Частный случай цепной реакции - реакция полимеризации.
Полимеризацией называется процесс, при котором реакция активных частиц (радикалов, ионов) с низкомолекулярными соединениями (мономерами) сопровождается последовательным присоединением последних с увеличением длины материальной цепи (длины молекулы), т. е. с образованием полимера.
Мономерами являются органические соединения, как правило, содержащие в составе молекулы непредельные (двойные, тройные) связи.
Основные стадии процесса полимеризации:
1. Инициирование (под действием света, нагревания и т. д.):
А: А → А" + А" - гомолитический распад с образованием радикалов (активные валентноненасыщенные частицы).
А: В → А - + В + - гетеролитический распад с образованием ионов.
2. Рост цепи: А" + М → АМ"
(или А - + М → АМ", или В + + М → ВМ +).
3. Обрыв цепи: АМ" + АМ" → полимер
(или АМ" + В + → полимер, ВМ + + А" → полимер).
Скорость цепного процесса всегда больше, чем нецепного.
В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, - несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе - за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, - нужно замедлить.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) - сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt . Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени :
n 2 − n 1 Δn
υ = –––––––––– = –––––––– = Δс/Δt (1)
(t 2 − t 1) v Δt v
где c = n / v - концентрация вещества,
Δ (читается «дельта») - общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO 2 + O 2 = 2SO 3
Скорость по кислороду будет: υ = 1: (10 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2: (10 1) = 0,2 моль/л·с - это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ . Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры . Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ . Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1) ! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Катализаторы - вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример - бурное разложение перекиси водорода при добавлении катализатора - оксида марганца (IV):
2H 2 O 2 = 2H 2 O + O 2
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы - вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров.
Изучением скорости химической реакции и условиями, влияющими на ее изменение, занимается одно из направлений физической химии - химическая кинетика. Она также рассматривает механизмы протекания этих реакций и их термодинамическую обоснованность. Эти исследования важны не только в научных целях, но и для контроля взаимодействия компонентов в реакторах при производстве всевозможных веществ.
Понятие скорости в химии
Скоростью реакции принято называть некое изменение концентраций, вступивших в реакцию соединений (ΔС) в единицу времени (Δt). Математическая формула скорости химической реакции выглядит следующим образом:
ᴠ = ±ΔC/Δt.
Измеряют скорость реакции в моль/л∙с, если она происходит во всем объеме (то есть реакция гомогенная) и в моль/м 2 ∙с, если взаимодействие идет на поверхности, разделяющей фазы (то есть реакция гетерогенная). Знак «-» в формуле имеет отношение к изменению значений концентраций исходных реагирующих веществ, а знак «+» - к изменяющимся значениям концентраций продуктов той же самой реакции.
Примеры реакций с различной скоростью
Взаимодействия химических веществ могут осуществляться с различной скоростью. Так, скорость нарастания сталактитов, то есть образования карбоната кальция, составляет всего 0,5 мм за 100 лет. Медленно идут некоторые биохимические реакции, например, фотосинтез и синтез белка. С довольно низкой скоростью протекает коррозия металлов.
Средней скоростью можно охарактеризовать реакции, требующие от одного до нескольких часов. Примером может послужить приготовление пищи, сопровождающееся разложением и превращением соединений, содержащихся в продуктах. Синтез отдельных полимеров требует нагревания реакционной смеси в течение определенного времени.
Примером химических реакций, скорость которых довольно высока, могут послужить реакции нейтрализации, взаимодействие гидрокарбоната натрия с раствором уксусной кислоты, сопровождающееся выделением углекислого газа. Также можно упомянуть взаимодействие нитрата бария с сульфатом натрия, при котором наблюдается выделение осадка нерастворимого сульфата бария.
Большое число реакций способно протекать молниеносно и сопровождаются взрывом. Классический пример - взаимодействие калия с водой.

Факторы, влияющие на скорость химической реакции
Стоит отметить, что одни и те же вещества могут реагировать друг с другом с различной скоростью. Так, например, смесь газообразных кислорода и водорода может довольно длительное время не проявлять признаков взаимодействия, однако при встряхивании емкости или ударе реакция приобретает взрывной характер. Поэтому химической кинетикой и выделены определенные факторы, которые имеют способность оказывать влияние на скорость химической реакции. К ним относят:
- природу взаимодействующих веществ;
- концентрацию реагентов;
- изменение температуры;
- наличие катализатора;
- изменение давления (для газообразных веществ);
- площадь соприкосновения веществ (если говорят о гетерогенных реакциях).
Влияние природы вещества
Столь существенное отличие в скоростях химических реакций объясняется разными значениями энергии активации (Е а). Под ней понимают некое избыточное количество энергии в сравнении со средним ее значением, необходимым молекуле при столкновении, для того чтобы реакция произошла. Измеряется в кДж/моль и значения обычно бывают в границах 50-250.

Принято считать, что если Е а =150 кДж/моль для какой-либо реакции, то при н. у. она практически не протекает. Эта энергия тратится на преодоление отталкивания между молекулами веществ и на ослабление связей в исходных веществах. Иными словами, энергия активации характеризует прочность химических связей в веществах. По значению энергии активации можно предварительно оценить скорость химической реакции:
- Е а < 40, взаимодействие веществ происходят довольно быстро, поскольку почти все столкнове-ния частиц при-водят к их реакции;
- 40-<Е а <120, предполагается средняя реакция, поскольку эффективными будет лишь половина соударений молекул (например, реакция цинка с соляной кислотой);
- Е а >120, только очень малая часть стол-кновений частиц приведет к реакции, и скорость ее будет низкой.
Влияние концентрации
Зависимость скорости реакции от концентрации вернее всего характеризуется законом действующих масс (ЗДМ), который гласит:
Скорость химической реакции имеет прямо пропорциональную зависимость от произведения концентраций, вступивших в реакцию веществ, значения которых взяты в степенях, соответствующих им стехиометрическим коэффициентам.
Этот закон подходит для элементарных одностадийных реакций, или же какой-либо стадии взаимодействия веществ, характеризующегося сложным механизмом.
Если требуется определить скорость химической реакции, уравнение которой можно условно записать как:
αА+ bB = ϲС, то,
в соответствии с выше обозначенной формулировкой закона, скорость можно найти по уравнению:
V=k·[A] a ·[B] b , где
a и b - стехиометрические коэффициенты,
[A] и [B] - концентрации исходных соединений,
k - константа скорости рассматриваемой реакции.

Смысл коэффициента скорости химической реакции заключается в том, что ее значение будет равно скорости, если концентрации соединений будут равны единицам. Следует отметить, что для правильного расчета по этой формуле стоит учитывать агрегатное состояние реагентов. Концентрацию твердого вещества принимают равной единице и не включают в уравнение, поскольку в ходе реакции она остается постоянной. Таким образом, в расчет по ЗДМ включают концентрации только жидких и газообразных веществ. Так, для реакции получения диоксида кремния из простых веществ, описываемой уравнением
Si (тв) + Ο 2(г) = SiΟ 2(тв) ,
скорость будет определяться по формуле:
Типовая задача
Как изменилась бы скорость химической реакции монооксида азота с кислородом, если бы концентрации исходных соединений увеличили в два раза?
Решение: Этому процессу соответствует уравнение реакции:
2ΝΟ + Ο 2 = 2ΝΟ 2 .
Запишем выражения для начальной (ᴠ 1) и конечной (ᴠ 2) скоростей реакции:
ᴠ 1 = k·[ΝΟ] 2 ·[Ο 2 ] и
ᴠ 2 = k·(2·[ΝΟ]) 2 ·2·[Ο 2 ] = k·4[ΝΟ] 2 ·2[Ο 2 ].
ᴠ 1 /ᴠ 2 = (k·4[ΝΟ] 2 ·2[Ο 2 ]) / (k·[ΝΟ] 2 ·[Ο 2 ]).
ᴠ 2 /ᴠ 1 = 4·2/1 = 8.
Ответ: увеличилась в 8 раз.

Влияние температуры
Зависимость скорости химической реакции от температуры была определена опытным путем голландским ученым Я. Х. Вант-Гоффом. Он установил, что скорость многих реакций возрастает в 2-4 раза с повышением температуры на каждые 10 градусов. Для этого правила имеется математическое выражение, которое имеет вид:
ᴠ 2 = ᴠ 1 ·γ (Τ2-Τ1)/10 , где
ᴠ 1 и ᴠ 2 - соответствующие скорости при температурах Τ 1 и Τ 2 ;
γ - температурный коэффициент, равен 2-4.
Вместе с тем это правило не объясняет механизма влияния температуры на значение скорости той или иной реакции и не описывает всей совокупности закономерностей. Логично сделать вывод о том, что с повышением температуры, хаотичное движение частиц усиливается и это провоцирует большее число их столкновений. Однако это не особо влияет на эффективность соударения молекул, поскольку она зависит, главным образом, от энергии активации. Также немалую роль в эффективности столкновения частиц имеет их пространственное соответствие друг другу.
Зависимость скорости химической реакции от температуры, учитывающая природу реагентов, подчиняется уравнению Аррениуса:
k = А 0 ·е -Еа/RΤ , где
А о - множитель;
Е а - энергия активации.
Пример задачи на закон Вант-Гоффа
Как следует изменить температуру, чтобы скорость химической реакции, у которой температурный коэффициент численно равен 3, выроста в 27 раз?
Решение. Воспользуемся формулой
ᴠ 2 = ᴠ 1 ·γ (Τ2-Τ1)/10 .
Из условия ᴠ 2 /ᴠ 1 = 27, а γ = 3. Найти нужно ΔΤ = Τ 2 -Τ 1 .
Преобразовав исходную формулу получаем:
V 2 /V 1 =γ ΔΤ/10 .
Подставляем значения: 27=3 ΔΤ/10 .
Отсюда понятно, что ΔΤ/10 = 3 и ΔΤ = 30.
Ответ: температуру следует повысить на 30 градусов.

Влияние катализаторов
В физической химии скорость химических реакций активно изучает также раздел, называемый катализом. Его интересует, как и почему сравнительно малые количества тех или иных веществ существенно увеличивают скорость взаимодействия других. Такие вещества, которые могут ускорять реакцию, но сами при этом в ней не расходуются, называются катализаторами.
Доказано, что катализаторы меняют механизм самого химического взаимодействия, способствуют появлению новых переходных состояний, для которых характерны меньшие высоты энергетического барьера. То есть они способствуют снижению энергии активации, а значит и увеличению количества эффективных ударений частиц. Катализатор не может вызвать реакцию, которая энергетически невозможна.
Так пероксид водорода способен разлагаться с образованием кислорода и воды:
Н 2 Ο 2 = Н 2 Ο + Ο 2 .
Но эта реакция очень медленная и в наших аптечках она существует в неизменном виде довольно долгое время. Открывая лишь очень старые флаконы с перекисью, можно заметить небольшой хлопок, вызванный давлением кислорода на стенки сосуда. Добавление же всего нескольких крупинок оксида магния спровоцирует активное выделение газа.
Та же реакция разложения перекиси, но уже под действием каталазы, происходит при обработке ран. В живых организмах находится много различных веществ, которые увеличивают скорость биохимических реакций. Их принято называть ферментами.
Противоположный эффект на протекание реакций оказывают ингибиторы. Однако это не всегда плохо. Ингибиторы используют для защиты металлической продукции от коррозии, для продления срока хранения пищи, например, для предотвращения окисления жиров.
Площадь соприкосновения веществ
В том случае, если взаимодействие идет между соединениями, имеющими разные агрегатные состояния, или же между веществами, которые не способны образовывать гомогенную среду (не смешивающиеся жидкости), то еще и этот фактор влияет на скорость химической реакции существенно. Связано это с тем, что гетерогенные реакции осуществляются непосредственно на границе раздела фаз взаимодействующих веществ. Очевидно, что чем обширнее эта граница, тем больше частиц имеют возможность столкнуться, и тем быстрее идет реакция.
Например, гораздо быстрее идет в виде мелких щепок, нежели в виде бревна. С той же целью многие твердые вещества растирают в мелкий порошок, прежде чем добавлять в раствор. Так, порошкообразный мел (карбонат кальция) быстрее действует с соляной кислотой, чем кусочек той же массы. Однако, помимо увеличения площади, данный прием приводит также к хаотичному разрыву кристаллической решетки вещества, а значит, повышает реакционную способность частиц.

Математически скорость гетерогенной химической реакции находят, как изменение количества вещества (Δν), происходящее в единицу вре-мени (Δt) на единице поверхности
(S): V = Δν/(S·Δt).
Влияние давления
Изменение давления в системе оказывает влияние лишь в том случае, когда в реакции принимают участие газы. Повышение давления сопровождается увеличением молекул вещества в единице объема, то есть концентрация его пропорционально возрастает. И наоборот, понижение давление приводит к эквивалентному уменьшению концентрации реагента. В этом случае подходит для вычисления скорости химической реакции формула, соответствующая ЗДМ.
Задача. Как возрастет скорость реакции, описываемой уравнением
2ΝΟ + Ο 2 = 2ΝΟ 2 ,
если объем замкнутой системы уменьшить в три раза (Т=const)?
Решение. При уменьшении объема пропорционально увеличивается давление. Запишем выражения для начальной (V 1) и конечной (V 2) скоростей реакции:
V 1 = k· 2 ·[Ο 2 ] и
V 2 = k·(3·) 2 ·3·[Ο 2 ] = k·9[ΝΟ] 2 ·3[Ο 2 ].
Чтобы найти во сколько раз новая скорость больше начальной, следует разделить левые и правые части выражений:
V 1 /V 2 = (k·9[ΝΟ] 2 ·3[Ο 2 ]) / (k·[ΝΟ] 2 ·[Ο 2 ]).
Значения концентраций и константы скорости сокращаются, и остается:
V 2 /V 1 = 9·3/1 = 27.
Ответ: скорость возросла в 27 раз.
Подводя итог, нужно отметить, что на скорость взаимодействия веществ, а точнее, на количество и качество столкновений их частиц, влияет множество факторов. В первую очередь - это энергия активации и геометрия молекул, которые практически невозможно скорректировать. Что касается остальных условий, то для роста скорости реакции следует:
- увеличить температуру реакционной среды;
- повысить концентрации исходных соединений;
- увеличить давление в системе или уменьшить ее объем, если речь идет о газах;
- привести разнородные вещества к одному агрегатному состоянию (например, растворив в воде) или увеличить площадь их соприкосновения.
Вопрос№3
От каких факторов зависит константа скорости химической реакции?
Константа скорости реакции (удельная скорость реакции ) - коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль /л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, от присутствия в системе катализатора, но не зависит от их концентрации.
1. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа) . При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле: (t2 - t1) / 10 Vt2 / Vt1 = g (где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции) . Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса: k = A e –Ea/RT где A - постоянная, зависящая от природы реагирующих веществ; R - универсальная газовая постоянная ; Ea - энергия активации, т. е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению. Энергетическая диаграмма химической реакции. Экзотермическая реакция Эндотермическая реакция А - реагенты, В - активированный комплекс (переходное состояние) , С - продукты. Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры. 2. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях) , чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения. 3. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии) , при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях) . Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
Вопрос№4
Сформулируйте и запишите закон действующих масс для реакции:
2 NO+O2=2NO2
ЗАКОН ДЕЙСТВУЮЩИХ МАСС: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. для реакции 2NO + O2 2NO2, закон действующих масс запишется так: v=kС2(NO)·С (O2), где k – константа скорости, зависящая от природы реагирующих веществ и температуры. Скорость в реакциях с участием твердых веществ определяется только концентрацией газов или растворенных веществ: С+О2=СО2, v =kCO2